现行教材对二氧化硫漂白性质的实验一直采取以下操作:将SO2气体通入装有品红溶液的试管,品红溶液的红色退去,再加热试管,红色又恢复,装置见图1。
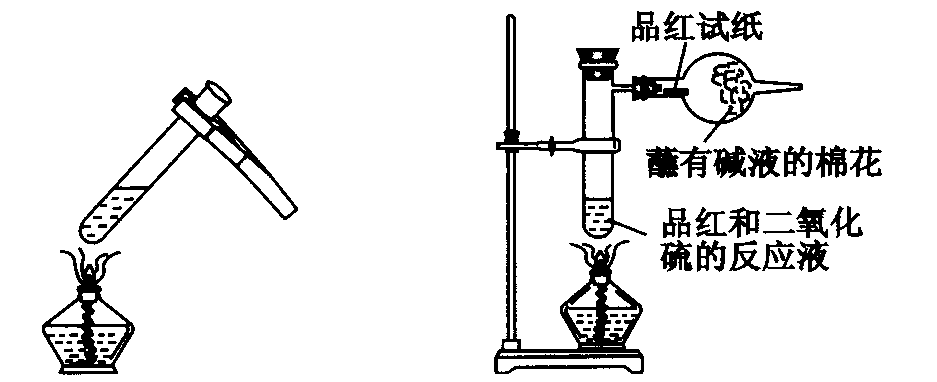
图1原实验装置
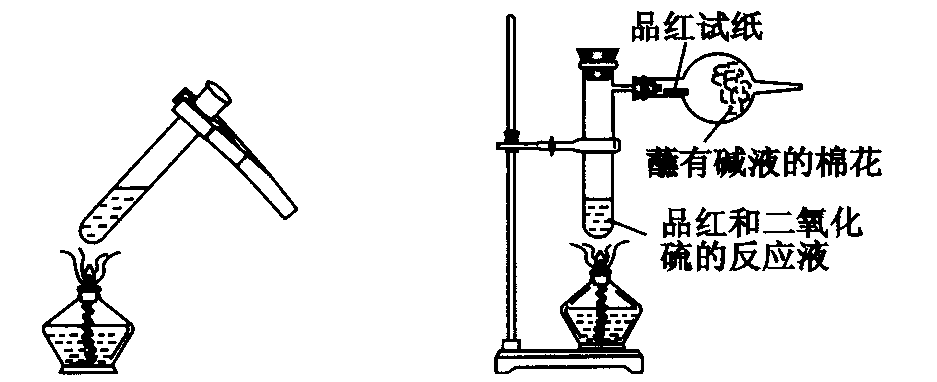
图2改进的实验装置
由此教材得出结论:“用二氧化硫漂白过的有色物质,在一定的条件下还可以恢复原来的颜色,这是因为二氧化硫和某些物质化合生成的无色物质不稳定,容易分解而恢复原来的颜色。”教师对该反应原理很清楚,但是学生不知道,这种操作能不能说明该反应原理?学生心中留有疑问,更重要的是,加热又分解出的SO2不经处理,直接排入空气中,没有考虑环境污染。为此,笔者特作了如图改动,实验装置见图2。
改进后操作亦较简单,实验现象能清晰地说明SO2和品红反应的实质。加热,品红试纸的红色再度出现,而品红溶液却退色,蘸有碱液的棉花可吸收可能散失的SO2。
