实验仪器及药品(包括浓度):
具支试管玻璃棒橡皮塞铁架台(带铁夹)酒精灯
双球干燥管铜丝(长约25cm、直径0.8mm)5%NaOH溶液
品红试剂蓝色石蕊试纸棉花滤纸蒸馏水
实验装置图:
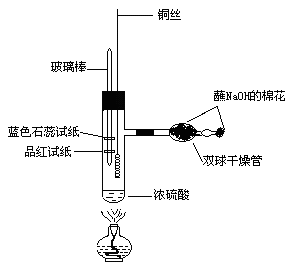
实验步骤:
1、按图连接装置。干燥管内放一团蘸过NaOH溶液的棉花,细管口也塞上。玻璃棒上分别缠绕一条湿润的蓝色石蕊试纸和品红试纸,吸取一滴管98%的浓H2SO4(约1.5ml),用铁架台竖立固定。
2、加热(在加热浓H2SO4时铜丝不要伸入浓H2SO4中),当浓H2SO4加热到接近沸腾(此时可以看到试管中有大量气泡并产生白雾)时,撤离酒精灯,迅速把铜丝伸入浓H2SO4中,反应立即发生,观察现象。
3、等蓝色石蕊试纸变红、品红试纸褪色立即把铜丝抽离硫酸,此时溶液是蓝绿色,几乎没有黑色。
实验注意事项:
1、在加热浓H2SO4时铜丝不要伸入浓H2SO4中。
2、必须将浓H2SO4加热到接近沸腾。
3、撤离酒精灯,立即将铜丝伸入浓H2SO4中。
4、等试纸变色后,立即把铜丝抽离硫酸。
教法说明:
铜与浓硫酸反应的实验是中学化学教学的一个重要演示实验,由于按照教材上的实验装置进行实验有可能造成有毒气体泄漏,不利于环保,并且对反应的进行不能加以有效的调控等缺点。本人为了达到绿色环保、现象明显、操作简便、能重复操作和调控反应进行等目的,设计了此实验装置。以下是此装置的优点:
1、反应具有可控制性,可根据需要随时停止反应,避免药品浪费和环境污染。
2、此装置可重复使用。
3、由于用品红试纸取代了品红溶液,反应见效快,缩短了实验时间,同时产生的SO2气体也大大减少,能被干燥管中的棉花完全吸收,避免环境污染。
4、反应后的溶液蓝绿色很明显,几乎没有黑色,稀释后溶液蓝色明显,效果很好。
附件:照片

